
【民眾黨臉書更新】10分鐘搞懂國產疫苗吵什麼?

「愛用國貨到底哪裡錯了?」
「不要唱衰國家生技產業!」
「不支持台灣國產疫苗,通通去打科興!」
厭倦了以上這些綠營側翼粉專二分法的情緒勒索,但你還是不知道國產疫苗到底在吵些什麼嗎?台灣民眾黨來幫你!
愛用國貨沒有錯,支持國家發展國產疫苗也有其必要性,但從蔡英文總統宣示國產疫苗7月上路後,國產疫苗的程序正義問題就面對各界質疑,先是陳時中在指揮中心記者會中幫國產疫苗只做二期試驗解讀為「二三期的延伸」,接著食藥署又公布審查標準是國際尚未認可的「免疫橋接」,用一個美國打槍的作法來取代三期臨床期中報告。
這樣的國產疫苗真的有保護力嗎?能夠取得國際認證嗎?打了出國不會受阻嗎?這些問題,我們都將在懶人包中一一說明。
我們要懇請各位,花十分鐘了解國產疫苗的技術、研發過程,以及目前的爭議點,#並且分享這個懶人包。希望藉由我們的介紹,能讓大家更理解COVID-19 疫苗,讓更多人能夠支持「政治力不能凌駕專業」這個原則,給國產疫苗更充裕的試驗時間,才能讓國產疫苗成為真正的台灣之光。
-
-
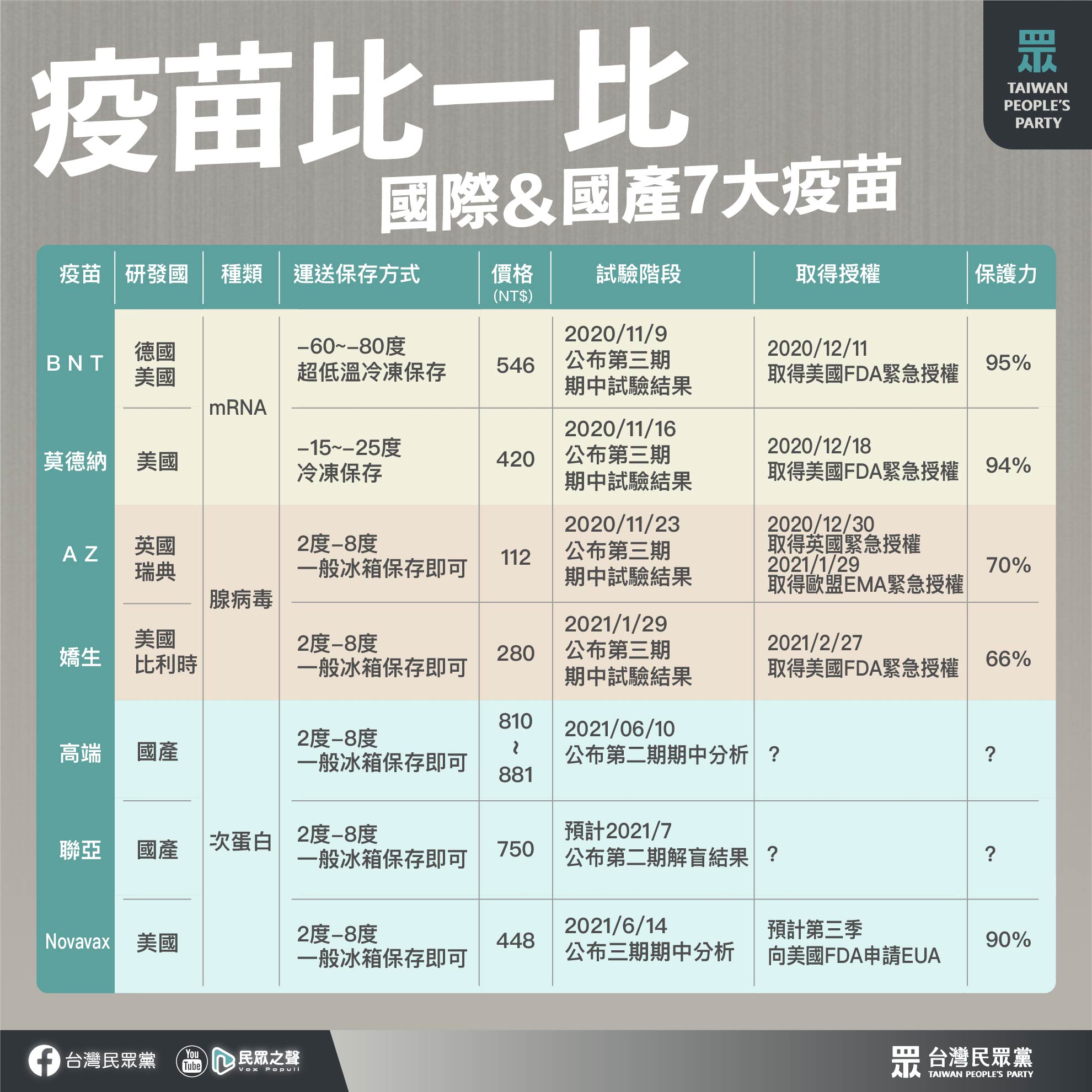
要脫離新冠肺炎的威脅,疫苗被認為是最重要的王牌。目前已經在全球獲准施打的新冠肺炎疫苗,以mRNA疫苗(如美國的莫德納及BNT)以及腺病毒載體疫苗(如英國的AZ或美國嬌生)為主。然而這兩種疫苗,都不是過去常用的疫苗製作方式。傳統的疫苗,是以死病毒、減毒病毒與重組蛋白疫苗為主(如美國Novavax、台灣國產高端、聯亞)。
價格上來說,這7種疫苗當中最高價的是國產高端疫苗,單劑量包裝的「預充填針劑」價格高達881元,最便宜的AZ疫苗則僅要價112元。
在如此多種的疫苗中,一般民眾會擔憂的問題,無非就是「有效性」、「安全性」。目前莫德納、BNT、AZ和嬌生四大國際疫苗皆已公布三期試驗期中成果,並取得美國或歐盟緊急授權,Novavax疫苗則於6月14日公布三期試驗期中分析,並預計第三季向美國申請緊急授權。
由英國牛津大學以及瑞典藥廠所研發的AZ疫苗,只需冷藏在2~8℃的環境下,比起BNT、莫德納需以-70°C、-20°C冷鏈運送保存,加上便宜的價格使AZ疫苗更便於推廣、保存和運輸,目前全球約有134個國家、地區使用AZ疫苗,雖然有傳出血栓疑慮,但其仍是全世界使用最廣泛的疫苗。
-

WHO和各國專家都曾提出警示,指出新冠疫情可能會朝「
總統蔡英文表示,如果台灣沒有自己供給疫苗的能量,未來
不過,台北市長柯文哲表示,認同國產疫苗是國防工業,但
-

總統蔡英文表示,如果台灣沒有自己供給疫苗的能量,未來
不過,台北市長柯文哲表示,認同國產疫苗是國防工業,但
-

除了國內多位政治領袖多次強調,台灣須擁有國產疫苗的自
亞洲生技大會主席李鍾熙就認同台灣須擁有自製國產疫苗的
-

由德國Biotech和美國輝瑞合作推出的BNT疫苗及美國莫德納(Moderna)推出的莫德納疫苗皆屬於屬「mRNA 技術」開發之疫苗。
「mRNA疫苗」是利用比DNA更小的mRNA送進人體細胞,並刺激細胞轉譯出新冠病毒的蛋白質構造,而再利用這個蛋白質構造去刺激人體的免疫系統,產生可以對抗病毒的抗體。
根據以色列的近120萬人的施打結果顯示,BNT疫苗整體保護力約95%,而且當時以色列境內流行英國變種病毒,更顯示BNT疫苗具有抵禦英國變種病毒的能力。
莫德納三期臨床數據顯示,其整體保護力約94%,根據《科學月刊》數據顯示,莫德納疫苗誘發的抗體效力,未因變異株而減退,代表面對英國變種病毒甚至印度變種病毒都具有一定的抵禦能力。
不過由於「mRNA」的分子結構較小也較不穩定,因此相較其他疫苗,在運送中需要極低溫的保存條件。BNT疫苗需全程以-70°C冷鏈運輸、保存;莫德納疫苗則需全程以-20°C冷鏈運送保存,目前仍無法在尚未建立完整冷鏈運輸供應鏈的國家、地區大量推廣。
-

由英國阿斯特捷利康(AstraZeneca)和牛津大學合作推出的AZ疫苗與美國嬌生(Janssen Biotech)推出的嬌生疫苗,皆屬於「腺病毒載體技術」開發之疫苗。
「腺病毒載體疫苗」是透過腺病毒混合一段失去自我複製能力的新冠病毒基因,並將這個腺病毒注射進人體內。而這個腺病毒會在人體中產生帶有新冠病毒表面的蛋白質,促發人體產生抗體,達到抗疫目的。
AZ疫苗的三期臨床試驗數據指出,整體保護力約 70%;嬌生的整體保護力則是約 66%,雖然效力不如使用mRNA技術開發的BNT、莫德納疫苗,腺病毒技術疫苗本身較穩定,在運送和保存上相對容易,是目前全世界最廣泛被使用的疫苗。
不過AZ疫苗在2021年3月上旬,於歐洲各國出現了數十件血栓的病例並造成數人死亡,歐洲多國立即暫停民眾接種AZ 疫苗。歐洲藥品管理局、英國藥品和醫療產品監管署於4月7日發佈聲明,指出牛津疫苗可能會引發血栓併血小板低下症候群,但由於疫情嚴峻,接種疫苗的利益仍大於風險,仍持續推動民眾施打。我國目前也以AZ疫苗作為國際疫苗主力供民眾施打。
-

由中國國藥集團推出的國藥疫苗與中國科興控股生物技術推出的科興疫苗,皆屬於「滅病毒技術」所開發之疫苗。
「滅病毒技術」是在體外培養大量真正的新冠病毒,然後將病毒消滅後,之後再將失去毒性的病毒注入體內,刺激免疫系統產生抗體,來達到抗疫的目的,並且由於體內免疫系統是面對真正的新冠病毒,可以誘發全面性的免疫反應。
國藥於5月26日於《美國醫學會雜誌 JAMA》發表的三期臨床試驗結果顯示,其整體保護力約 72%;科興疫苗的三期臨床試驗結果則顯示其整體保護力約50%,並且由於科興疫苗三期臨床試驗中的60歲以上的受試者較少,對於年長者的保護力仍有待論定,並且有體內抗體無法維持,導致接種者失去保護力的隱憂。
-

蛋白質次單位疫苗歷史悠久,像是B肝疫苗、子宮頸癌疫苗,都是採用這個技術;透過將病毒表面的棘蛋白,利用基因工程技術,培養出病毒蛋白並純化,最後將純化的病毒蛋白注射進體內,藉以刺激人體免疫反應。
目前包括高端、聯亞以及日前公布三期期中分析報告的Novavax,都是蛋白質次單位疫苗,而相較於其他疫苗技術,蛋白質次單位疫苗安全性高、不良反應較少,且不須低溫冷鏈,保存運輸更便利;但也有開發時程長、效力較差的缺點。
值得一提的是,高端、聯亞及國光三家生技公司,在研發COVID-19疫苗上均採取蛋白質次單位疫苗,相較於其他國家研發疫苗採取兩到三個技術平台以分散風險,中研院院士陳培哲就直言,台灣的疫苗研發宛如「雞蛋放在同一個籃子裡」。
-
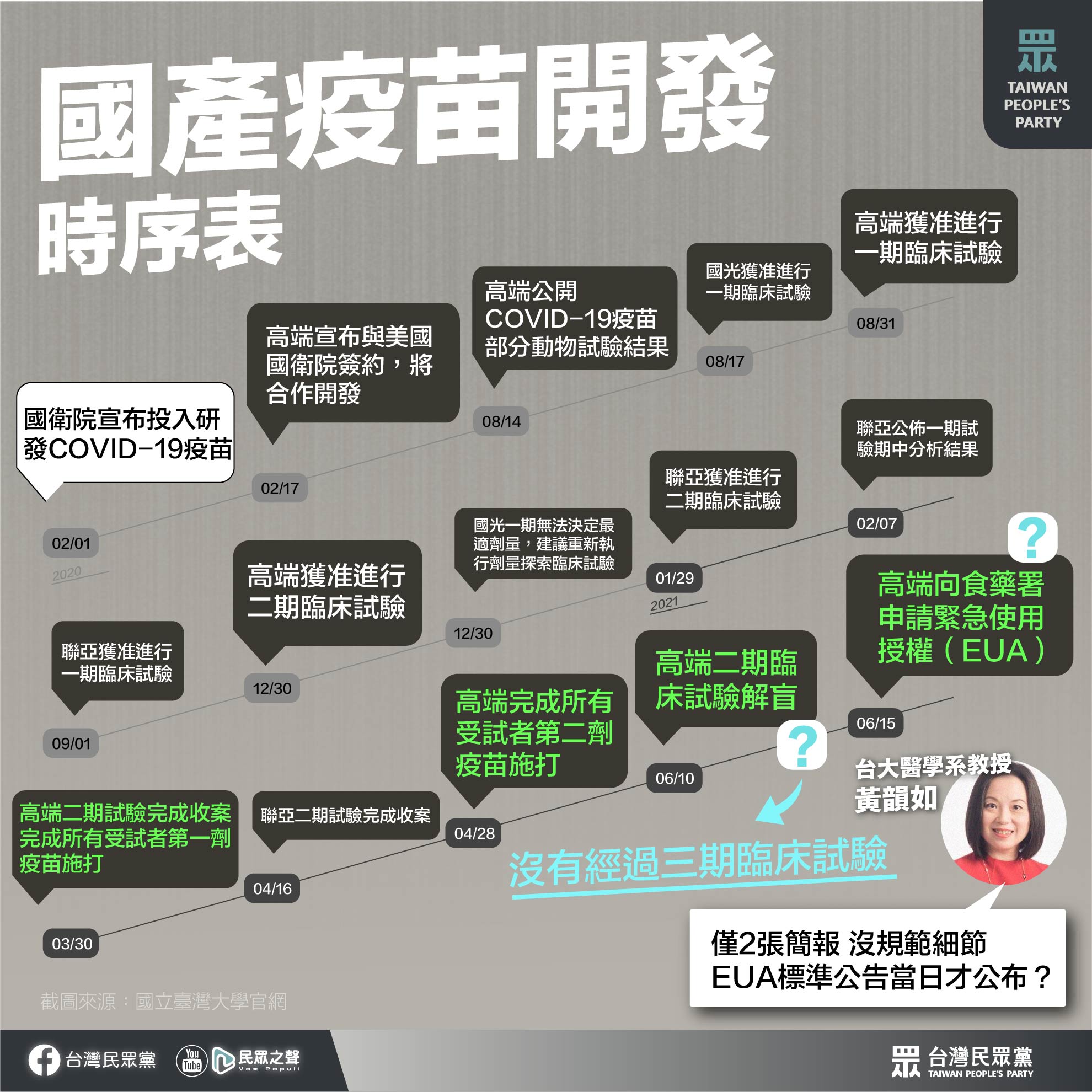
自去年2月宣示成立疫苗國家隊以來,國內幾家生技大廠都投入COVID-19疫苗的研發工作,然而老牌大廠國光生技在一期試驗後卡關,僅有高端、聯亞順利進入二期。
相較於國際疫苗,台灣的國產疫苗開發進度稍稍落後,高端本月10日完成二期解盲,聯亞也預計在本月底二期解盲,而高端在未做三期試驗的情況下就向食藥署申請緊急使用授權(EUA),與其他國際大廠均做到三期試驗並取得期中報告後才申請EUA的情況大不相同。
-

中國國務院去年中陸續批准國藥、科興COVID-19疫苗緊急使用,俄羅斯8月也宣布投入使用「衛星五號」(Sputnik-V)疫苗,但兩國宣布疫苗使用時,疫苗的三期試驗才做幾天甚至還沒開始,這幾款疫苗也是目前僅作二期試驗就申請EUA的COVID-19疫苗。
事實上,包括AZ、BNT、莫德納、嬌生等國際疫苗,都是在公布三期試驗期中報告後才申請EUA,日前民進黨網路社群中心主任范綱皓宣稱「國外疫苗跟國產一樣只通過二期」,是罔顧事實的說法。
-

雖然國產疫苗之一的高端疫苗在6/10公布二期解盲成功,但時代力量立委陳椒華認為,高端疫苗公布的僅是安全性測試報告而非有效性報告,多數受試者尚未完成自接種第一劑起共209天的試驗程序,且尚未完成全部受試者的抗體檢測,而這樣的「二期試驗期中分析」僅能得知部分成效。
台大醫院臨床試驗中心主任陳建煒同樣指出,這次公布的報告主要是看安全性、耐受性與免疫生成性的評估數據,少了最關鍵的「保護力」,不能說是二期完全解盲而是期中分析,且以免疫生成性作為疫苗施打與否的指標,目前仍有爭議存在,而國外已經施打的疫苗,也多是看疫苗對受試者能產生多大的保護力,才能證明施打疫苗真的有效。
蔡英文總統曾保證,「安全、有效是疫苗上市的基本條件」,即使國產疫苗因技術選擇安全性較高,但多數國際疫苗均進行三期試驗取得報告證明效力後,才申請緊急使用授權(EUA)、大規模施打,國產疫苗在缺乏足夠科學證據證明其效力的情況下,真的可以就這樣通過EUA,在國人的手臂上施打嗎?
-
.jpg)
衛福部在高端疫苗解盲當天上午公布國產COVID-19疫苗緊急使用授權(EUA)審查標準,採用「免疫橋接」取代三期試驗,這樣的方式可說是全球首創,連衛福部長陳時中都坦言:「現在還沒有這樣子通過(EUA)的」。
所謂免疫橋接,是指受試者在施打疫苗後的血清能產生中和抗體,且其產生的抗體量與效價,能與已上市的疫苗相比,衛福部所公布的EUA審查標準,就是以國產疫苗與AZ疫苗相比,要求「國產疫苗第二期臨床試驗所得中和抗體效價必須證明不劣於AZ疫苗。」
-

台灣首創的EUA審查方式引發專家學者憂心,中研院士陳培哲就直言,如果政府執意第二期臨床試驗結束立即給予EUA,台灣醫藥產業的專業和獨立性就會被搞壞,不符合國際研究規範的國產疫苗也會變成國際孤兒。
事實上,免疫橋接還未獲得國際共識,WHO仍在討論中,美國食藥局(FDA)也持保留態度,而FDA日前將不再審查COVID-19疫苗的EUA,許多國際大廠的疫苗也將申請藥證,如果台灣堅持以免疫橋接的方式審查EUA,國產疫苗在缺乏三期試驗的情況下,如何取得國際認證將是一大隱憂。
-

由微軟創辦人比爾蓋茲(Bill Gates)投資的德國生技大廠所製造的CVnCoV疫苗,即使二期數據優秀達標,但今日三期試驗期中報告出爐,有效性僅47%,實驗失敗。顯示即使二期試驗順利通過,可保證疫苗安全性,但缺乏三期試驗證明其保護力,仍無法確認疫苗是有效的。
對此,醫師潘建志認為,從CVnCoV疫苗失敗的經驗來看,食藥署以200位接種AZ疫苗的部桃醫護血中抗體和高端二期抗體濃度做比較,是不可靠的;疾管署人體研究倫理審查委員劉宏恩也提醒,僅從二期試驗得到的數據來「推論」疫苗效力是充滿不確定性的,而保護效力不確定的疫苗可能對社會防疫有害。
-

許多國家隨著疫苗接種率升高陸續解封,歐盟將於7月起推行疫苗護照,日本等眾多國家也考慮跟進,其自由入境的條件幾乎都是施打國際認證的疫苗,然而衛福部長陳時中日前在國會答詢時坦承「國產疫苗有不被國際認證的風險」,令國人擔心若施打國產疫苗,未來出國是否會受阻。
對於打國產疫苗能不能出國這題,陳時中部長曾解釋「能出國但檢疫方式恐有差別」,間接地證實了國人的憂慮,若國產疫苗未獲國際認證,未來國人即使施打疫苗,入境他國時可能會遭遇較嚴格的檢疫措施,大大地影響了國人出國經商旅遊的權益。
-

目前台灣外購疫苗1981萬劑,另向兩家國產疫苗廠商各採購500萬劑。不過外購疫苗到貨率不甚理想,目前僅到貨111.66萬劑,但美、日各捐贈250萬劑、124萬劑,在台灣疫苗短缺的此刻無疑是及時雨,除了感謝國際友人的援助外,我們也期望外購疫苗到貨率能有所提升。
WHO和各國專家都曾示警,COVID-19可能流感化,未來可能每年都得施打疫苗增加保護力,在這樣的情況下,國產疫苗即使晚點上路也不會無用武之地。
在面臨疫情威脅的當下,應採取「國際認證疫苗為主,國內疫苗為輔」的疫苗政策,採購足量國際疫苗作為主力施打,為國產疫苗爭取時間和空間,按部就班地做好該做的試驗、順利取得國際認證,而非急就章匆促上路。
-

民眾黨一直都強調:我們絕對支持研發國產疫苗,才不會讓台灣的疫苗政策受制於他國,但一切應符合國際科學程序。目前如AZ、BNT、莫德納、嬌生等國際主流疫苗都經過三期試驗並取得期中報告,證明效力後才申請EUA並大規模施打,台灣的國產疫苗不該冒著孤立於世界之外的風險,另立遊戲規則。
疫苗是科學專業的議題,從研發、試驗到審查,一切判斷應以科學證據為主,不該以政治力或意識形態干預科學,才能讓國產疫苗達到安全、有效且獲得國際認證的目標,成為真正的台灣之光。
---
亞洲生技大會主席李鍾熙就認同台灣須擁有自製國產疫苗的
-

由德國Biotech和美國輝瑞合作推出的BNT疫苗及美國莫德納(Moderna)推出的莫德納疫苗皆屬於屬「mRNA 技術」開發之疫苗。
「mRNA疫苗」是利用比DNA更小的mRNA送進人體細胞,並刺激細胞轉譯出新冠病毒的蛋白質構造,而再利用這個蛋白質構造去刺激人體的免疫系統,產生可以對抗病毒的抗體。
根據以色列的近120萬人的施打結果顯示,BNT疫苗整體保護力約95%,而且當時以色列境內流行英國變種病毒,更顯示BNT疫苗具有抵禦英國變種病毒的能力。
莫德納三期臨床數據顯示,其整體保護力約94%,根據《科學月刊》數據顯示,莫德納疫苗誘發的抗體效力,未因變異株而減退,代表面對英國變種病毒甚至印度變種病毒都具有一定的抵禦能力。
不過由於「mRNA」的分子結構較小也較不穩定,因此相較其他疫苗,在運送中需要極低溫的保存條件。BNT疫苗需全程以-70°C冷鏈運輸、保存;莫德納疫苗則需全程以-20°C冷鏈運送保存,目前仍無法在尚未建立完整冷鏈運輸供應鏈的國家、地區大量推廣。
-

由英國阿斯特捷利康(AstraZeneca)和牛津大學合作推出的AZ疫苗與美國嬌生(Janssen Biotech)推出的嬌生疫苗,皆屬於「腺病毒載體技術」開發之疫苗。
「腺病毒載體疫苗」是透過腺病毒混合一段失去自我複製能力的新冠病毒基因,並將這個腺病毒注射進人體內。而這個腺病毒會在人體中產生帶有新冠病毒表面的蛋白質,促發人體產生抗體,達到抗疫目的。
AZ疫苗的三期臨床試驗數據指出,整體保護力約 70%;嬌生的整體保護力則是約 66%,雖然效力不如使用mRNA技術開發的BNT、莫德納疫苗,腺病毒技術疫苗本身較穩定,在運送和保存上相對容易,是目前全世界最廣泛被使用的疫苗。
不過AZ疫苗在2021年3月上旬,於歐洲各國出現了數十件血栓的病例並造成數人死亡,歐洲多國立即暫停民眾接種AZ 疫苗。歐洲藥品管理局、英國藥品和醫療產品監管署於4月7日發佈聲明,指出牛津疫苗可能會引發血栓併血小板低下症候群,但由於疫情嚴峻,接種疫苗的利益仍大於風險,仍持續推動民眾施打。我國目前也以AZ疫苗作為國際疫苗主力供民眾施打。
-

由中國國藥集團推出的國藥疫苗與中國科興控股生物技術推出的科興疫苗,皆屬於「滅病毒技術」所開發之疫苗。
「滅病毒技術」是在體外培養大量真正的新冠病毒,然後將病毒消滅後,之後再將失去毒性的病毒注入體內,刺激免疫系統產生抗體,來達到抗疫的目的,並且由於體內免疫系統是面對真正的新冠病毒,可以誘發全面性的免疫反應。
國藥於5月26日於《美國醫學會雜誌 JAMA》發表的三期臨床試驗結果顯示,其整體保護力約 72%;科興疫苗的三期臨床試驗結果則顯示其整體保護力約50%,並且由於科興疫苗三期臨床試驗中的60歲以上的受試者較少,對於年長者的保護力仍有待論定,並且有體內抗體無法維持,導致接種者失去保護力的隱憂。
-

蛋白質次單位疫苗歷史悠久,像是B肝疫苗、子宮頸癌疫苗,都是採用這個技術;透過將病毒表面的棘蛋白,利用基因工程技術,培養出病毒蛋白並純化,最後將純化的病毒蛋白注射進體內,藉以刺激人體免疫反應。
目前包括高端、聯亞以及日前公布三期期中分析報告的Novavax,都是蛋白質次單位疫苗,而相較於其他疫苗技術,蛋白質次單位疫苗安全性高、不良反應較少,且不須低溫冷鏈,保存運輸更便利;但也有開發時程長、效力較差的缺點。
值得一提的是,高端、聯亞及國光三家生技公司,在研發COVID-19疫苗上均採取蛋白質次單位疫苗,相較於其他國家研發疫苗採取兩到三個技術平台以分散風險,中研院院士陳培哲就直言,台灣的疫苗研發宛如「雞蛋放在同一個籃子裡」。
-

自去年2月宣示成立疫苗國家隊以來,國內幾家生技大廠都投入COVID-19疫苗的研發工作,然而老牌大廠國光生技在一期試驗後卡關,僅有高端、聯亞順利進入二期。
相較於國際疫苗,台灣的國產疫苗開發進度稍稍落後,高端本月10日完成二期解盲,聯亞也預計在本月底二期解盲,而高端在未做三期試驗的情況下就向食藥署申請緊急使用授權(EUA),與其他國際大廠均做到三期試驗並取得期中報告後才申請EUA的情況大不相同。
-

中國國務院去年中陸續批准國藥、科興COVID-19疫苗緊急使用,俄羅斯8月也宣布投入使用「衛星五號」(Sputnik-V)疫苗,但兩國宣布疫苗使用時,疫苗的三期試驗才做幾天甚至還沒開始,這幾款疫苗也是目前僅作二期試驗就申請EUA的COVID-19疫苗。
事實上,包括AZ、BNT、莫德納、嬌生等國際疫苗,都是在公布三期試驗期中報告後才申請EUA,日前民進黨網路社群中心主任范綱皓宣稱「國外疫苗跟國產一樣只通過二期」,是罔顧事實的說法。
-

雖然國產疫苗之一的高端疫苗在6/10公布二期解盲成功,但時代力量立委陳椒華認為,高端疫苗公布的僅是安全性測試報告而非有效性報告,多數受試者尚未完成自接種第一劑起共209天的試驗程序,且尚未完成全部受試者的抗體檢測,而這樣的「二期試驗期中分析」僅能得知部分成效。
台大醫院臨床試驗中心主任陳建煒同樣指出,這次公布的報告主要是看安全性、耐受性與免疫生成性的評估數據,少了最關鍵的「保護力」,不能說是二期完全解盲而是期中分析,且以免疫生成性作為疫苗施打與否的指標,目前仍有爭議存在,而國外已經施打的疫苗,也多是看疫苗對受試者能產生多大的保護力,才能證明施打疫苗真的有效。
蔡英文總統曾保證,「安全、有效是疫苗上市的基本條件」,即使國產疫苗因技術選擇安全性較高,但多數國際疫苗均進行三期試驗取得報告證明效力後,才申請緊急使用授權(EUA)、大規模施打,國產疫苗在缺乏足夠科學證據證明其效力的情況下,真的可以就這樣通過EUA,在國人的手臂上施打嗎?
-
.jpg)
衛福部在高端疫苗解盲當天上午公布國產COVID-19疫苗緊急使用授權(EUA)審查標準,採用「免疫橋接」取代三期試驗,這樣的方式可說是全球首創,連衛福部長陳時中都坦言:「現在還沒有這樣子通過(EUA)的」。
所謂免疫橋接,是指受試者在施打疫苗後的血清能產生中和抗體,且其產生的抗體量與效價,能與已上市的疫苗相比,衛福部所公布的EUA審查標準,就是以國產疫苗與AZ疫苗相比,要求「國產疫苗第二期臨床試驗所得中和抗體效價必須證明不劣於AZ疫苗。」
-

台灣首創的EUA審查方式引發專家學者憂心,中研院士陳培哲就直言,如果政府執意第二期臨床試驗結束立即給予EUA,台灣醫藥產業的專業和獨立性就會被搞壞,不符合國際研究規範的國產疫苗也會變成國際孤兒。
事實上,免疫橋接還未獲得國際共識,WHO仍在討論中,美國食藥局(FDA)也持保留態度,而FDA日前將不再審查COVID-19疫苗的EUA,許多國際大廠的疫苗也將申請藥證,如果台灣堅持以免疫橋接的方式審查EUA,國產疫苗在缺乏三期試驗的情況下,如何取得國際認證將是一大隱憂。
-

由微軟創辦人比爾蓋茲(Bill Gates)投資的德國生技大廠所製造的CVnCoV疫苗,即使二期數據優秀達標,但今日三期試驗期中報告出爐,有效性僅47%,實驗失敗。顯示即使二期試驗順利通過,可保證疫苗安全性,但缺乏三期試驗證明其保護力,仍無法確認疫苗是有效的。
對此,醫師潘建志認為,從CVnCoV疫苗失敗的經驗來看,食藥署以200位接種AZ疫苗的部桃醫護血中抗體和高端二期抗體濃度做比較,是不可靠的;疾管署人體研究倫理審查委員劉宏恩也提醒,僅從二期試驗得到的數據來「推論」疫苗效力是充滿不確定性的,而保護效力不確定的疫苗可能對社會防疫有害。
-

許多國家隨著疫苗接種率升高陸續解封,歐盟將於7月起推行疫苗護照,日本等眾多國家也考慮跟進,其自由入境的條件幾乎都是施打國際認證的疫苗,然而衛福部長陳時中日前在國會答詢時坦承「國產疫苗有不被國際認證的風險」,令國人擔心若施打國產疫苗,未來出國是否會受阻。
對於打國產疫苗能不能出國這題,陳時中部長曾解釋「能出國但檢疫方式恐有差別」,間接地證實了國人的憂慮,若國產疫苗未獲國際認證,未來國人即使施打疫苗,入境他國時可能會遭遇較嚴格的檢疫措施,大大地影響了國人出國經商旅遊的權益。
-

目前台灣外購疫苗1981萬劑,另向兩家國產疫苗廠商各採購500萬劑。不過外購疫苗到貨率不甚理想,目前僅到貨111.66萬劑,但美、日各捐贈250萬劑、124萬劑,在台灣疫苗短缺的此刻無疑是及時雨,除了感謝國際友人的援助外,我們也期望外購疫苗到貨率能有所提升。
WHO和各國專家都曾示警,COVID-19可能流感化,未來可能每年都得施打疫苗增加保護力,在這樣的情況下,國產疫苗即使晚點上路也不會無用武之地。
在面臨疫情威脅的當下,應採取「國際認證疫苗為主,國內疫苗為輔」的疫苗政策,採購足量國際疫苗作為主力施打,為國產疫苗爭取時間和空間,按部就班地做好該做的試驗、順利取得國際認證,而非急就章匆促上路。
-

民眾黨一直都強調:我們絕對支持研發國產疫苗,才不會讓台灣的疫苗政策受制於他國,但一切應符合國際科學程序。目前如AZ、BNT、莫德納、嬌生等國際主流疫苗都經過三期試驗並取得期中報告,證明效力後才申請EUA並大規模施打,台灣的國產疫苗不該冒著孤立於世界之外的風險,另立遊戲規則。
疫苗是科學專業的議題,從研發、試驗到審查,一切判斷應以科學證據為主,不該以政治力或意識形態干預科學,才能讓國產疫苗達到安全、有效且獲得國際認證的目標,成為真正的台灣之光。
---
老朋友,歡迎上線回娘家
民眾黨黨員重整及繳交黨費作業起跑!
教學懶人包  https://reurl.cc/KAx8yq
https://reurl.cc/KAx8yq
全新官網,重磅改版登場!
回列表
回列表








